 Foto de grupo. De izquierda a derecha: Inmaculada López Almela, Mireia Palanca Gisbert, Alba Espí Malillos, Juliette Poujol de Molliens, Carla Palacios Gorba, Yuval Markovich, Juan José Quereda Torres.
Foto de grupo. De izquierda a derecha: Inmaculada López Almela, Mireia Palanca Gisbert, Alba Espí Malillos, Juliette Poujol de Molliens, Carla Palacios Gorba, Yuval Markovich, Juan José Quereda Torres.
Listeriosis: situación actual
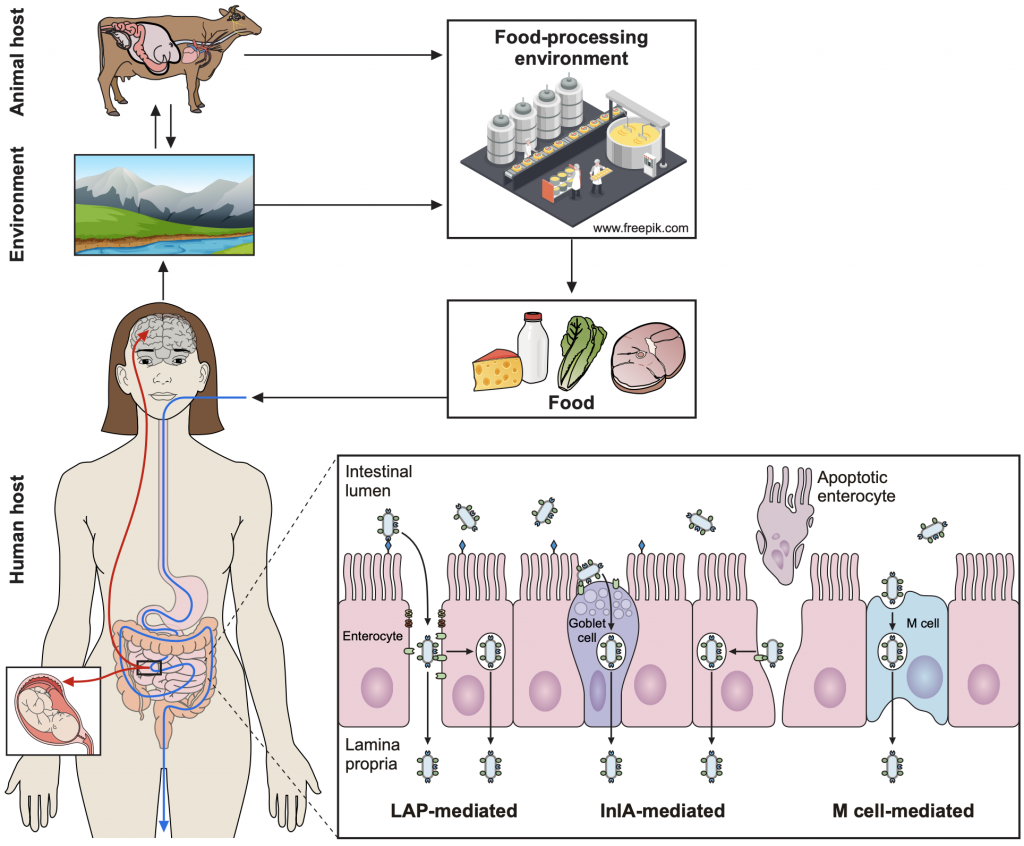
La listeriosis es la zoonosis transmitida por alimentos más grave y con mayor tasa de hospitalización y letalidad. La listeriosis es causada por L. monocytogenes, un patógeno bacteriano distribuido globalmente en una amplia variedad de especies de mamíferos y no mamíferos domésticos y salvajes. L. monocytogenes es una bacteria Gram-positiva intracelular facultativa, osmo y halotolerante que crece en un amplio rango de temperaturas (entre 1 °C y 45 °C) y pH (5-9) (Quereda et al., 2021 Virulence). A pesar de que diferentes países han adoptado rigurosas normas de seguridad alimentaria, siguen produciéndose importantes brotes de listeriosis en todo el mundo (por ejemplo: Sudáfrica en 2017 con 1.060 afectados, España en 2019 con 222 afectados). En un estudio que evaluó la situación epidemiológica de la listeriosis en España según el registro de hospitalizaciones (Herrador et al., 2019), entre 1997 y 2015 se produjeron 5.696 hospitalizaciones por listeriosis. Es importante destacar que la incidencia de la enfermedad en España fue aumentando durante todo el periodo de estudio, especialmente en los mayores de 65 años. Estos resultados de prevalencia resaltan la necesidad de comprender las rutas de circulación y los reservorios de esta bacteria. Tanto en humanos como en animales, la infección por L. monocytogenes se atribuye principalmente al consumo de alimentos contaminados.
ScEYEnce Studios. Garland Science. KVIR-2020-0377. Figure: Graphical Abstract
Género Listeria
El género Listeria incluye actualmente 27 especies reconocidas de pequeñas bacterias grampositivas con forma de bastón ubicuas en la naturaleza. Una de las últimas especies fue descubierta por nuestro grupo y recibió el nombre de Listeria valentina en referencia a Valencia, región donde se encontró la bacteria (Quereda et al., 2020 Int J Syst Evol Microbiol). L. monocytogenes se encuentra en el suelo, el agua, la vegetación, el barro y el ensilado, así como en una amplia gama de especies animales. También se ha detectado L. monocytogenes en las heces de personas sanas, con una prevalencia de portadores fecales de L. monocytogenes en la población general del 10%. Los rumiantes y los animales salvajes pueden ser portadores de L. monocytogenes y frecuentemente excretan este patógeno en las heces, diseminándolo en la granja y el medio ambiente.
Hoy en día, las autoridades reguladoras consideran que todas las cepas aisladas de L. monocytogenes son igual de virulentas. Sin embargo, la población de L. monocytogenes es diversa. El linaje I se aísla con mayor frecuencia en muestras de pacientes clínicamente afectados, mientras que las cepas del linaje II son más frecuentes en los alimentos. Tradicionalmente, la mayoría de los estudios de patogénesis de L. monocytogenes se han realizado con cepas de referencia del linaje II aisladas en muy pocas ocasiones de pacientes con signos clínicos. El uso continuado de estas cepas de referencia ha llevado a una subestimación de la biodiversidad de L. monocytogenes y, por tanto, de la heterogeneidad que puede existir en los mecanismos de virulencia utilizados por las cepas del linaje I y II.
Historia del grupo
Nuestro grupo empezó en 2018 tras recibir un contrato Ramón y Cajal, seguido de proyectos del Ministerio (PID2019 y PID2022) y de la Generalitat Valenciana para Grupos Emergentes y posteriormente para Grupos Consolidados (GV/2018//183 y AICO 2021). Aplicando técnicas de epidemiología molecular y secuenciación del genoma completo, nuestro grupo ha descubierto una de las últimas especies del género Listeria, L. valentina (Quereda et al., 2020 Int J Syst Evol Microbiol) y ha demostrado como el complejo clonal de L. monocytogenes más prevalente asociado con la listeriosis humana (CC1) está precisamente fuertemente asociado a los rumiantes (Palacios-Gorba et al., 2021 Environ Microbiol). Nuestro grupo ha estudiado el rol de distintos factores bacterianos y de la célula eucariota que median durante la infección (Quereda et al., 2018 Vet Res; 2019 Clin Microbiol Infect; 2022 J Infect Dis). Asimismo, hemos descubierto también el estado de portador asintomático de L. monocytogenes en los animales domésticos y salvajes, identificando las tonsilas como órgano reservorio de este patógeno (Palacios-Gorba et al., 2021 Applied and Environ Microbiol; 2023 Microbes and Infection). Nuestro grupo ha descrito la existencia de infecciones atípicas de Listeria en casos de linfadenitis mesentérica en animales de compañía, revelando la diversidad genómica de las cepas en las lesiones y evidenciando la importancia de los animales de compañía en el ciclo biológico de L. monocytogenes (Garcia-de la Virgen & López-Almela et al., 2024 J Vet Intern Med). Finalmente realizando estudios de cinética de crecimiento y proteómica hemos podido revelar porque los clones hipervirulentos de L. monocytogenes se asocian principalmente a productos lácteos a la vez que hemos podido entender como este patógeno readapta su proteoma de membrana y pared a las condiciones de productos derivados del hospedador como es la leche (Espí-Malillos et al., 2024 Microbes and Infection).
El grupo aplica enfoques genómicos desde la perspectiva One-Health para comprender mejor el comportamiento, la transmisión, la virulencia y la evolución del género Listeria y su asociación con huéspedes humanos y animales. Desarrollamos proyectos multidisciplinares basados en diversas disciplinas que incluyen la sanidad animal, epidemiología, genómica, microbiología y biología molecular. Comprender los reservorios, la epidemiología, los mecanismos moleculares de patogénesis y la diversidad genética y fenotípica de L. monocytogenes ayudará a entender como esta bacteria cambia su estilo de vida de saprófito a patógeno, mejorando la salud humana y animal, reduciendo la transmisión de patógenos y la contaminación de los productos alimenticios de origen animal para finalmente aumentar la seguridad alimentaria.
Publicaciones representativas
Espí-Malillos A, Palacios-Gorba C, López-Almela I, Ruiz-García P, López-Mendoza MC, García-Del Portillo F, Pucciarelli MG, Quereda JJ. Kinetic and proteomic studies in milk show distinct patterns among major Listeria monocytogenes clones. Microbes Infect. 2024
Garcia-de la Virgen M, López-Almela I, Moura A, Vázquez S, Perez-Montagud S, Leclercq A, Lecuit M, Quereda JJ. Clinical and genomic features of Listeria monocytogenes-associated mesenteric lymphadenitis in a cat. J Vet Intern Med. 2024
Barba M, Toquet M, García-Roselló E, Gomis J, Quereda JJ, González-Torres P, Carbonetto B, Gómez-Martín Á. Description of the vaginal microbiota in nulliparous ewes during natural mating and pregnancy: preliminary signs of the male preputial microbiota modulation. Front Microbiol. 2024
Toledo-Perona R, Contreras A, Gomis J, Quereda JJ, García-Galán A, Sánchez A, Gómez-Martín A. Controlling Coxiella burnetii in naturally infected sheep, goats and cows, and public health implications: a scoping review. Front. Vet. Sci. 2024.
Palacios-Gorba C, Moura A, Markovich Y, Tessaud-Rita N, Gómez-Martín Á, Bracq-Dieye H, Gomis J, Vales G, Pastor-Martín M, Thouvenot P, Escrig C, Leclercq A, Lecuit M, Quereda JJ. Genomic characterization of Listeria spp. isolated from tonsils, udder and feces of domestic dairy ruminants in Spain. Microbes Infect. 2023
Quereda JJ, Morel C, Lopez-Montero N, Ziveri J, Rolland S, Grenier T, Aulner N, Danckaert A, Charbit A, Enninga J, Cossart P, Pizarro-Cerdá J. A Role for Taok2 in Listeria monocytogenes Vacuolar Escape. J Infect Dis. 2022
Palacios-Gorba C, Moura A, Gomis J, Leclercq A, Gómez-Martín Á, Bracq-Dieye H, Mocé ML, Tessaud-Rita N, Jiménez-Trigos E, Vales G, García-Muñoz Á, Thouvenot P, García-Roselló E, Lecuit M, Quereda JJ. Ruminant-associated Listeria monocytogenes isolates belong preferentially to dairy-associated hypervirulent clones: a longitudinal study in 19 farms. Environ Microbiol. 2021
Quereda JJ, Morón-García A, Palacios-Gorba C, Dessaux C, García-Del Portillo F, Pucciarelli MG, Ortega AD. Pathogenicity and virulence of Listeria monocytogenes: A trip from environmental to medical microbiology. Virulence. 2021
Meza-Torres J, Lelek M, Quereda JJ, Sachse M, Manina G, Ershov D, Tinevez JY, Radoshevich L, Maudet C, Chaze T, Giai Gianetto Q, Matondo M, Lecuit M, Martin-Verstraete I, Zimmer C, Bierne H, Dussurget O, Cossart P, Pizarro-Cerdá J. Listeriolysin S: A bacteriocin from Listeria monocytogenes that induces membrane permeabilization in a contact-dependent manner. Proc Natl Acad Sci U S A. 2021
Palacios-Gorba C, Moura A, Leclercq A, Gómez-Martín Á, Gomis J, Jiménez-Trigos E, Mocé ML, Lecuit M, Quereda JJ.Listeria spp. Isolated from Tonsils of Wild Deer and Boars: Genomic Characterization. Appl Environ Microbiol. 2021
Gómez-Laguna J, Cardoso-Toset F, Meza-Torres J, Pizarro-Cerdá J, Quereda JJ. Virulence potential of Listeria monocytogenes strains recovered from pigs in Spain. Vet Rec. 2020
Quereda JJ, Leclercq A, Moura A, Vales G, Gómez-Martín Á, García-Muñoz Á, Thouvenot P, Tessaud-Rita N, Bracq-Dieye H, Lecuit M. Listeria valentina sp. nov., isolated from a water trough and the faeces of healthy sheep. Int J Syst Evol Microbiol. 2020
Quereda JJ, Rodríguez-Gómez IM, Meza-Torres J, Gómez-Laguna J, Nahori MA, Dussurget O, Carrasco L, Cossart P, Pizarro-Cerdá J. Reassessing the role of internalin B in Listeria monocytogenes virulence using the epidemic strain F2365. Clin Microbiol Infect. 2019
Quereda JJ, Andersson C, Cossart P, Johansson J, Pizarro-Cerdá J. Role in virulence of phospholipases, listeriolysin O and listeriolysin S from epidemic Listeria monocytogenes using the chicken embryo infection model. Vet Res. 2018
Kühbacher A, Novy K, Quereda JJ, Sachse M, Moya-Nilges M, Wollscheid B, Cossart P, Pizarro-Cerdá J. Listeriolysin O-dependent host surfaceome remodeling modulates Listeria monocytogenes invasion. Pathog Dis. 2018
