
Foto de grupo. De izquierda a derecha, Yasser Mahmmod, Miguel Blanco, Pau Obregón, Virginia Aragón, Berenice Plasencia, Flor Correa, Carlos Neila, Sergi López, Marina Sibila, Nuria Galofré, Eva Huerta y Mar Costa
Existe una gran presión para la reducción en el uso de antimicrobianos, por el constante aumento de las resistencias y el inminente problema para la salud de los animales y las personas. En España, se está trabajando a través de un plan nacional, el PRAN, y, aunque el uso de antimicrobianos todavía es alto, cabe resaltar la drástica reducción del 97% en uso de colistina en cerdos entre 2015 y 2018. En la producción porcina, las enfermedades respiratorias representan uno de los mayores problemas sanitarios y en consecuencia son una de las principales causas de uso de antimicrobianos en este sector.
Unos de los patógenos respiratorios de importancia en el sector porcino es Haemophilus parasuis, que causa la enfermedad de Glässer (poliserositis fibrinosa, incluidas meningitis y artritis). Durante años nuestro grupo se ha centrado en el estudio de la patogenicidad de esta bacteria con el objetivo final de desarrollar una vacuna eficaz. A través de estudios de tipado genético, ensayos de virulencia e infecciones experimentales en lechones, definimos distintos grados de virulencia en las cepas de campo y se detectó un grupo de moléculas asociadas a dicha virulencia, los autotransportadores triméricos VtaA. Los VtaAs son proteínas antigénicas localizadas en la membrana externa, que se expresan durante la infección del cerdo. Los VtaAs son factores de virulencia, involucrados en mecanismos como adhesión a proteínas de la matriz extracelular o resistencia a la fagocitosis. El análisis de su estructura nos permitió definir un epítopo expuesto en la superficie bacteriana, común a todas los VtaA de las cepas virulentas. Los anticuerpos frente a este epítopo son opsonizantes y permitirían dirigir la respuesta específicamente a las cepas virulentas. Además, al estar presente el epítopo en todas los VtaA asociadas con virulencia, se evitaría el intercambio antigénico (“antigenic switching”) entre diferentes VtaAs.
En los últimos años nuestro interés se ha ampliado a otros patógenos porcinos, como Mycoplasma hyorhinis y Streptococcus suis, y al papel de la microbiota nasal. La cavidad nasal es la vía natural de entrada de los patógenos respiratorios, y allí encuentran la primera barrera frente a la infección, la microbiota nasal. La comparación de esta microbiota en lechones de granjas con enfermedad de Glässer frente a la de lechones sanos nos permitió determinar que la microbiota nasal puede predisponer a los lechones a sufrir enfermedades. Observamos que varios taxones bacterianos, como Bacteroidales, Lactobacillales y Clostridiales, estaban reducidos en la microbiota nasal en lechones destetados que luego desarrollaron la enfermedad de Glässer. La enfermedad de Glässer está producida por las cepas virulentas de H. parasuis, pero esta bacteria también tiene cepas no virulentas, que pueden proteger frente a la enfermedad. La microbiota asociada con estos dos tipos de cepas de H parasuis resultó ser diferente, detectándose algunas familias bacterianas que podrían facilitar la colonización de cepas virulentas de H. parasuis (y por lo tanto aumentar el riesgo de enfermedad), y otras distintas que podrían facilitar la colonización de cepas no virulentas (y por lo tanto promover la protección frente a la enfermedad de Glässer). Estos hallazgos apoyan la idea de que se pueden diseñar intervenciones específicas para conseguir una composición de la microbiota adecuada para garantizar la protección de los lechones. Pero el papel de la microbiota nasal no es específico de la enfermedad de Glässer, y lechones que luego desarrollaron poliserositis por M. hyorhinis tenían una composición muy diferente a la de los lechones de granjas sanas, con distintos géneros bacterianos asociados a salud y enfermedad.
Además, los antimicrobianos puede tener efectos colaterales en la microbiota beneficiosa. Recientemente hemos demostrado que la eliminación de tratamientos antimicrobianos perinatales produce un aumento de la diversidad bacteriana en la microbiota nasal. Este aumento de diversidad tiene efectos beneficiosos a largo plazo, con una reducción en la mortalidad y en el coste de medicación, y un aumento productivo. Los cambios más significativos en la composición de la microbiota al eliminar los antimicrobianos fueron un aumento en Prevotella y Lactobacillus, y una reducción de Moraxella y Bergeyella (Figura 1).
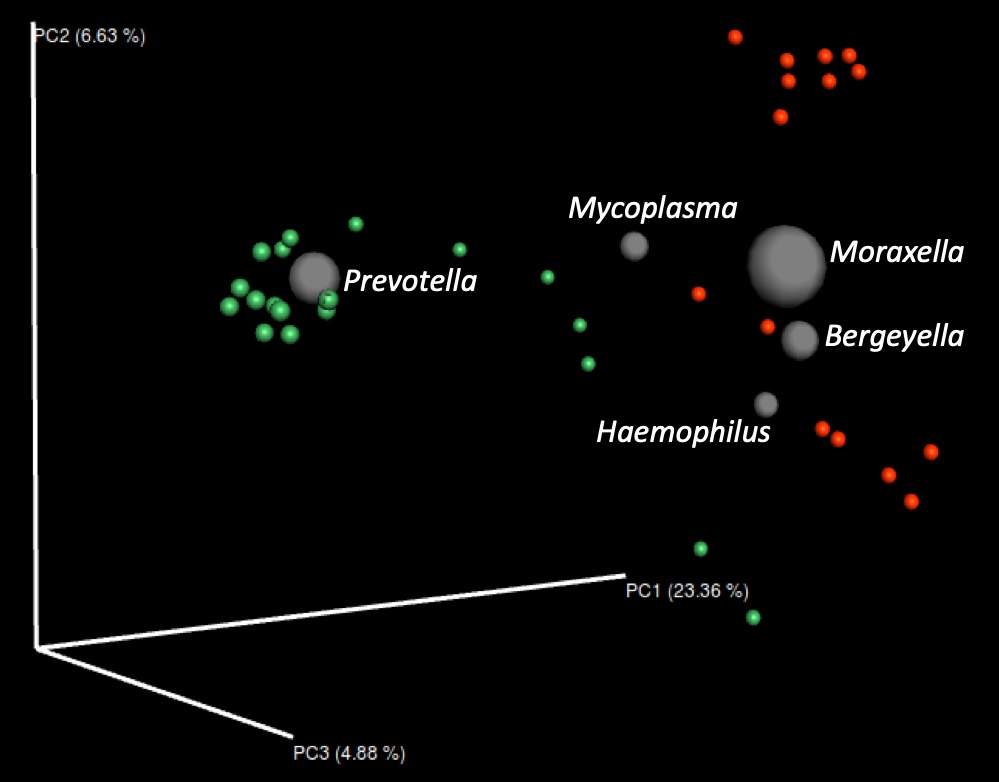
Figura 1. Análisis de coordenadas principales (PC) mostrando la diversidad beta de la microbiota nasal de lechones al destete (3-4 semanas de vida) antes (puntos rojos) y después (puntos verdes) de la eliminación de los tratamientos antimicrobianos perinatales. Las esferas grises indican los 5 géneros más abundantes y son proporcionales a su abundancia relativa.
Nuestro grupo tiene también experiencia en otros patógenos respiratorios de gran importancia económica a nivel mundial como son Mycoplasma hyopneumoniae y Actinobacillus pleuropneumoniae, agentes causales de neumonía y pleuroneumonía en cerdos. Cabe destacar la puesta a punto de los modelos de enfermedad en cerdo, que son de gran utilidad para estudios de nuevos productos terapéuticos, vacunas o para la validación de herramientas diagnósticas. Además, se ha determinado que el diagnóstico de M. hyopneumoniae mejora usando hisopos laríngeos en animales vivos y muestras del tracto respiratorio inferior (lavado brocoalveolar o hisopo pulmonar) en animales muertos, y se han establecidos métodos de cuantificación de lesiones pulmonares para ambos patógenos.
Nuestro objetivo de futuro continuará siendo el control de las enfermedades respiratorias porcinas en ausencia de antibióticos, con especial énfasis en estrategias alternativas, como el desarrollo de probióticos.
Publicaciones representativas
Betlach AM, Maes D, Garza-Moreno L, Tamiozzo P, Sibila M, Haesebrouck F, Segalés J, Pieters M. (2019). Mycoplasma hyopneumoniae variability: Current trends and proposed terminology for genomic classification. Transbound Emerg Dis 66:1840-54.
Costa-Hurtado M, Garcia-Rodriguez L, Lopez-Serrano S y Aragon V. (2019). Haemophilus parasuis VtaA2 is involved in adhesion to extracellular proteins. Vet Res 50:69.
Correa-Fiz F, Gonçalves Dos Santos JM, Illas F y Aragon V. (2019). Antimicrobial removal on piglets promotes health and higher bacterial diversity in the nasal microbiota. Sci Rep 9:6545.
Garza-Moreno L, Segalés J, Aragón V, Correa-Fiz F, Pieters M, Carmona M, Krejci R y Sibila M. (2019). Characterization of Mycoplasma hyopneumoniae strains in vaccinated and non-vaccinated pigs from Spanish slaughterhouses. Vet Microbiol 231:18-23.
Garcia-Morante B, Dors A, León-Kempis R, Pérez de Rozas A, Segalés J, Sibila M. (2018) Assessment of the in vitro growing dynamics and kinetics of the non-pathogenic J and pathogenic 11 and 232 Mycoplasma hyopneumoniae strains. Vet Res 49:45.
Fernández-Aguilar X, Gottschalk M, Aragon V, Càmara J, Ardanuy C, Velarde R, Galofré-Milà N, Castillo-Contreras R, López-Olvera JR, Mentaberre G, Colom-Cadena A, Lavín S y Cabezón O. (2018). Urban Wild Boars and Risk for Zoonotic Streptococcus suis, Spain. Emerg Infect Dis 24(6):1083-6.
Mathieu-Denoncourt A, Letendre C, Auger JP, Segura M, Aragon V, Lacouture S y Gottschalk M. (2018). Limited interactions between Streptococcus suis and Haemophilus parasuis in in vitro co-infection studies. Pathogens 7(1). pii: E7.
Howell KJ, Weinert LA, Peters SE, Wang J, Hernandez-Garcia J, Chaudhuri RR, Luan SL, Angen Ø, Aragon V, Williamson SM, Langford PR, Rycroft AN, Wren BW, Maskell DJ y Tucker AW. (2017). «Pathotyping» Multiplex PCR Assay for Haemophilus parasuis: a Tool for Prediction of Virulence. J Clin Microbiol 55:2617-28.
Correa-Fiz F, Galofre-Mila N, Costa-Hurtado M y Aragon V. (2017). Identification of a surface epitope specific of virulent strains of Haemophilus parasuis. Vet Microbiol 198:116-20.
Correa-Fiz F, Fraile L y Aragon V. (2016). Piglet nasal microbiota at weaning may influence the development of Glässer’s disease during the rearing period. BMC Genomics 17:404.
