
Foto de grupo. De izquierda a derecha: Alba Vázquez Barca (doctoranda), Carlos Rodríguez Osorio (IP), Saqr Abushattal (doctorando), Xosé Manuel Matanza Fente (doctorando), Ana Vences Lorenzo (postdoctoral), Laura López Suárez (doctoranda).
El grupo de trabajo sobre Photobacterium damselae tiene más de 20 años de experiencia en el estudio de este importante patógeno de la acuicultura de peces marinos a escala mundial. Esta especie comprende dos subespecies, damselae y piscicida, que causan patologías muy diferentes debido a un interesante proceso de especiación a través del cual cada subespecie ha adquirido elementos genéticos móviles portando factores de virulencia únicos.
P. damselae subsp. damselae puede considerarse un patógeno generalista, que afecta a una gran diversidad de peces, así como a crustáceos y moluscos, y es un patógeno oportunista para el ser humano, pudiendo causar septicemias mortales. Las cepas altamente virulentas contienen un plásmido, pPHDD1, que codifica dos potentes citotoxinas, la damselisina y la fobalisina P, mientras que una tercera hemolisina, fobalisina C, está codificada en el cromosoma. La damselisina actúa en sinergia con las dos fobalisinas para causar importantes daños celulares, y nuestros recientes estudios de transcriptómica y proteómica demuestran que los genes de estas toxinas están entre los más altamente expresados por esta bacteria, las toxinas se producen en grandes cantidades, y son secretadas por el sistema de secreción de tipo II. Las cepas que carecen del plásmido pPHDD1 son menos virulentas en ensayos de laboratorio, pero curiosamente se aíslan con gran frecuencia a partir de brotes en piscifactorías, y en nuestro grupo hemos identificado una nueva fosfolipasa cromosómica que contribuye a la virulencia y a la citotoxicidad en estas cepas.
Este patógeno muestra una elevada diversidad genética, y nuestros estudios recientes demuestran que en un mismo brote coexisten genotipos de P. damselae subsp. damselae muy diversos. Así, de un mismo lote de peces enfermos se aíslan cepas con y sin plásmido, y es de especial relevancia la gran diversidad que existe en los genes que codifican los polisacáridos de la envuelta celular. Esta elevada diversidad genética nos condujo a buscar algún punto débil que fuese ubicuo en las poblaciones de este patógeno. Así, recientemente hemos descubierto un sistema regulador de dos componentes al que hemos denominado RstAB, cuya mutación prácticamente anula la virulencia, causa una drástica disminución en la expresión de los genes de las citotoxinas, y tiene consecuencias negativas en la transcripción de otros factores de virulencia adicionales, así como en la morfología celular. Este sistema está presente en todos los aislados de esta subespecie y es un prometedor punto de partida para diseñar estrategias de control de este patógeno, además de un interesante modelo de estudio de la regulación de la virulencia. Por el momento desconocemos los estímulos que desencadenan la activación del sistema RstAB, si bien sí hemos determinado que una caída en la salinidad del medio estimula la producción de las citotoxinas y de otros factores de virulencia.
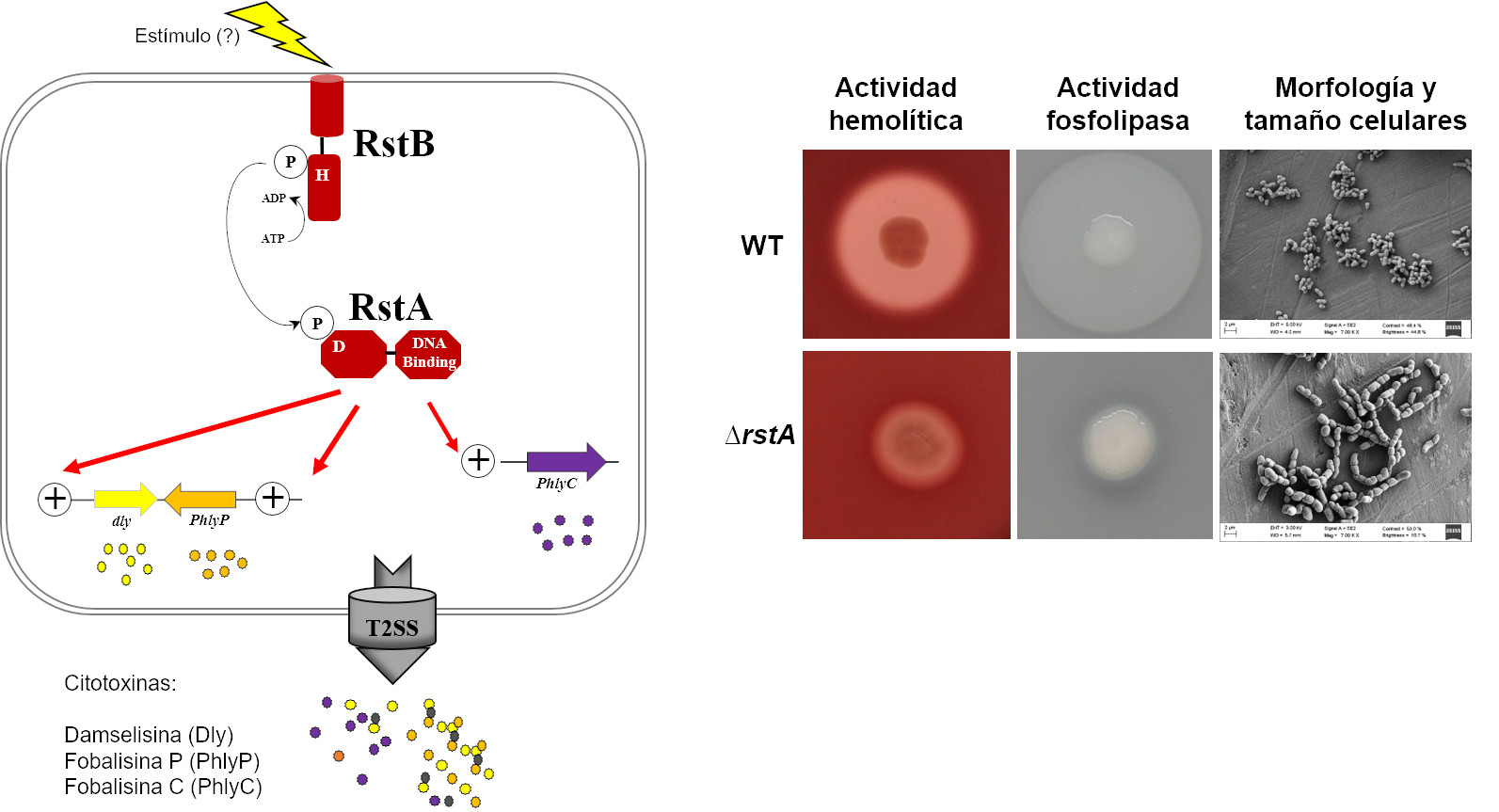
Figura 1. El sistema regulador de dos componentes RstAB regula las tres principales citotoxinas del patógeno P. damselae subsp. damselae, que son secretadas por el sistema de secreción de tipo 2 (T2SS) y causan graves daños en las células del hospedador. En el panel de la derecha se puede apreciar que la mutación de este sistema prácticamente anula la producción de las citotoxinas (con actividades hemolítica y fosfolipasa), y altera enormemente el tamaño celular, así como la separación de las células hijas tras la división.
Por otra parte, P. damselae subsp. piscicida es un patógeno exclusivo de peces, en los que causa la fotobacteriosis o pseudotuberculosis, una enfermedad de especial transcendencia en el área mediterránea por las grandes pérdidas económicas que causa en los cultivos de dorada y de lubina. En los genomas de las cepas de esta subespecie se ha producido un complejo proceso de acumulación de elementos de inserción. Como consecuencia, en los genomas de la subsp. piscicida ha tenido lugar una reducción masiva de funciones génicas, unido ello a una evolución hacia un modo de vida muy asociado al pez hospedador. El factor de virulencia mejor estudiado en esta subespecie es la toxina AIP56, que induce apoptosis en macrófagos y neutrófilos de los peces, y se secreta en altos niveles a través del sistema de secreción de tipo II. Esta toxina está codificada en un pequeño plásmido (pPHDP10) de tan sólo 9 kilobases. Además, muchas cepas de esta subespecie contienen un plásmido, pPHDP70, que incluye en su estructura una isla de patogenicidad con los genes de síntesis y utilización del sideróforo piscibactina. Muy recientemente, en nuestro grupo de trabajo hemos contribuido a la primera evidencia de la existencia de un sistema de secreción de tipo III en esta subespecie. Lejos de tratarse de un sistema anecdótico en este patógeno, nuestros datos recientes revelan una presencia muy amplia de este sistema de secreción en la subsp. piscicida, lo cual nos ha abierto nuevos horizontes en el estudio de la patobiología de esta subespecie.
Nuestros estudios actuales están encaminados a aplicar los conocimientos adquiridos en los más de 20 años de estudio de estos dos patógenos, para ofrecer nuevas estrategias de diagnóstico, de prevención y de control de las enfermedades causadas tanto por la subsp. damselae como por la subsp. piscicida.
Publicaciones recientes del grupo
Terceti MS, Vences A, Matanza XM, Barca AV, Noia M, Lisboa J, Dos Santos NMS, Do Vale A y Osorio CR. (2019). The RstAB system impacts virulence, motility, cell morphology, penicillin tolerance and production of Type II secretion system-dependent factors in the fish and human pathogen Photobacterium damselae subsp. damselae. Front Microbiol, 10:897.
Abushattal S, Vences A, Dos Santos NMS, Do Vale A y Osorio CR. (2019). Draft genome sequences of Photobacterium damselae subsp. piscicida SNW-8.1 and PP3, two fish-isolated strains containing a Type III secretion system. Microbiology Resource Announcements. e00426-19
Osorio CR. (2019). Photobacterium damselae: How horizontal gene transfer shaped two different pathogenic lifestyles in a marine bacterium. En: Horizontal gene transfer: breaking borders between living kingdoms. pp. 175-199. (T.G. Villa & M. Viñas, eds.). Ed. Springer, Suíza. ISBN: 978-3-030-21861-4.
Matanza XM y Osorio CR. (2018). Transcriptome changes in response to temperature in the fish pathogen Photobacterium damselae subsp. damselae: clues to understand the emergence of disease outbreaks at increased seawater temperatures. PLoS One. 13(12): e0210118.
Terceti MS, Vences A, Matanza XM, Dalsgaard I, Pedersen K y Osorio CR. (2018). Molecular epidemiology of Photobacterium damselae subsp. damselae outbreaks in marine rainbow trout farms reveals extensive horizontal gene transfer and high genetic diversity. Front Microbiol. 9:2155.
Osorio CR, Vences A, Matanza XM y Terceti MS. (2018). Photobacterium damselae subsp. damselae, a generalist pathogen with unique virulence factors and high genetic diversity. J Bacteriol. JB.00002-18.
Vences A, Rivas AJ, Lemos ML, Husmann M y Osorio CR. (2017). Chromosome-encoded hemolysin, phospholipase, and collagenase in plasmidless strains of Photobacterium damselae subsp. damselae contribute to virulence for fish. Appl Environ Microbiol, 83: e00401-17.
Terceti MS, Rivas AJ, Alvarez L, Noia M, Cava F y Osorio C.R. (2017). rstB regulates expression of the Photobacterium damselae subsp. damselae major virulence factors Damselysin, Phobalysin P and Phobalysin C. Front Microbiol, 8:582.
Terceti MS, Ogut H y Osorio CR. (2016). Photobacterium damselae subsp. damselae, an emerging fish pathogen in the Black Sea: evidences of a multiclonal origin. Appl Environ Microbiol. 82:3736-3745.
Rivas AJ, Vences A, Husmann M, Lemos ML y Osorio CR. (2015). Photobacterium damselae subsp. damselae major virulence factors Dly, HlyApl and HlyAch are secreted via the type II secretion system. Infect Immun. 83: 1246-1256.
