
Foto de grupo. De izquierda a derecha: Ramón Santamaría, Margarita Díaz, Sergio Antoraz, Hector Rodríguez y David Sanz.
El grupo de investigación dirigido por los doctores Ramón Santamaría y Margarita Díaz ha centrado su investigación en diferentes aspectos de la biología de las bacterias del género Streptomyces. Tres son los aspectos principales que nos atraen de estos microorganismos: 1) producen una amplia variedad de antibióticos y antitumorales; 2) son habitantes normales del suelo donde interactúan con otros organismos y participan en la descomposición de materia orgánica; 3) producen grandes cantidades de enzimas hidrolíticas algunas de ellas con potencial industrial.
Hasta la fecha, el interés más importante de los microorganismos del género Streptomyces, con más de 500 especies descritas, es su capacidad para producir antibióticos y antitumorales (producen más del 50 % de todos los antibióticos naturales disponibles). Ese potencial se ha visto incrementado tras secuenciar más de 150 especies y observar que todas ellas poseen múltiples clusters biosintéticos que, inactivos en las condiciones de laboratorio, están implicados en la síntesis de metabolitos secundarios desconocidos. El conseguir la producción e identificación de estos metabolitos crípticos y conseguir niveles de producción adecuados, incluso de los metabolitos ya conocidos, es una tarea en la que están implicados multitud de grupos y empresas a nivel mundial utilizando aproximaciones muy variadas. La obtención de nuevos compuestos bioactivos que hagan frente a los problemas de resistencia a antibióticos es uno de los retos más importantes de este siglo.
Nosotros nos estamos enfrentando a este reto utilizando dos estrategias diferentes. Por un lado, nos hemos centrado en el estudio de regulación que ejercen diferentes sistemas de dos componentes sobre la producción de antibióticos con objeto de poder manipular esta regulación y potenciar rutas de producción de antibióticos conocidos y/o activar rutas silenciadas de producción. En este caso, utilizamos S. coelicolor como modelo, y ya hemos estudiado el efecto que ejercen seis sistemas de dos componentes sobre la producción de antibióticos mediante la mutación de los genes que los integran (Yepes et al. 2011). Actualmente estamos profundizando en el estudio de los tres que más efecto tienen, y hemos descrito que los sistemas que denominamos AbrA1/A2 y AbrB1/B2 ejercen un efecto negativo sobre la producción de antibióticos (Rico et al. 2014a, Sanz et al. Resultados no publicados) mientras que el sistema AbrC1/C2/C3 (sistema atípico, compuesto por dos quinasas y un regulador) ejerce un efecto positivo sobre la producción de antibióticos. El empleo de las cepas delecionadas en los sistemas negativos como cepas hospedadoras para la expresión heteróloga de distintas rutas de antitumorales nos ha permitido demostrar su utilidad al duplicar su producción respecto a la cepa parental (Rico et al. 2014a). Además, la sobreexpresión del regulador positivo AbrC3 en otras especies de Streptomyces induce la producción de metabolitos endógenos en las mismas y puede ayudarnos a descubrir nuevas moléculas bioactivas de interés para la medicina producidas por diferentes especies (Rico et al. 2014b y resultados no publicados).
Por otro lado, nos hemos centrado en el efecto que ejerce la interacción de microorganismos del género Streptomyces con otros microorganismos del suelo sobre la producción de antibióticos conocidos y sobre la activación de rutas silenciadas.
Nuestra hipótesis de trabajo, junto con la de otros grupos, es que muchas de las rutas de biosíntesis presentes en los genomas de los Streptomyces que están silenciadas en condiciones de laboratorio, podrían activarse en respuesta a la interacción con otros organismos mediante una señalización molecular entre ellos de un modo similar al que debe ocurrir en el hábitat natural.De hecho, el estudio que hemos iniciado muestra que la estimulación de la producción de algunos antibióticos ocurre realmente en co-cultivos de Streptomyces con otros microorganismos como Myxococcus o Bacillus (Pérez et al. 2011). El identificar las moléculas inductoras de este efecto es de gran interés ya que permitirá su posterior empleo en los medios de producción para la inducción de estas rutas sin necesidad de recurrir a co-cultivos.
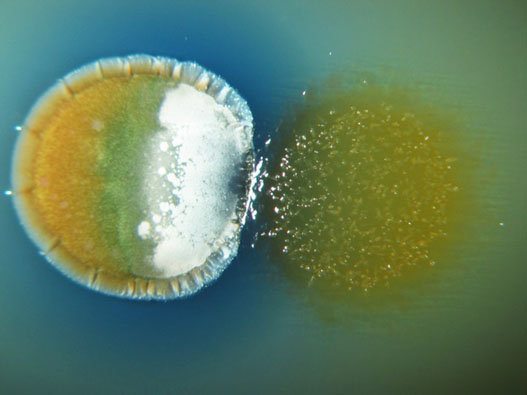
Figura 1. Interacción entre Streptomyces coelicolor (izda) y Myxococcus xanthus (dcha). En la zona de interacción se estimula la producción de actinorrodina (color azul).
La tercera línea de trabajo del grupo se centra en la capacidad de producción de enzimas hidrolíticas secretadas que estos microorganismos poseen y que les permiten degradar la materia orgánica de su nicho biológico principal, el suelo, y utilizar los nutrientes generados para su desarrollo. Esta capacidad secretora, entre otras características, hace de Streptomyces una alternativa muy importante como hospedador para la expresión de proteínas heterólogas de interés.
Nuestro grupo tiene mucha experiencia en el estudio la producción de enzimas hidrolíticas implicadas en la degradación de materiales lignocelulósicos por estas bacterias. Uno de los frutos de ese trabajo ha sido la identificación de varios promotores fuertes regulados por la fuente de carbono presente en los medios de cultivo que han sido empleados en diferentes vectores para la sobreexpresión de diferentes proteínas de interés industrial en Streptomyces (Díaz et al. 2008, 2011, Aragón et al. 2013). Este estudio se ha complementado con el desarrollo de vectores de expresión para Streptomyces basados en una selección positiva al no requerir la adición de antibióticos para su mantenimiento. Para este fin hemos utilizado el sistema toxina-antitoxina YoeB/YefM de S. lividans que hemos Durante el desarrollo de este sistema de expresión hemos generado una cepa en la que hemos delecionado todo el sistema YoeB/YefM del genoma y en la que descrito recientemente y que ha sido el primer sistema toxina-antitoxina descrito funcionalmente en Streptomyces (Sevillano et al. 2012).
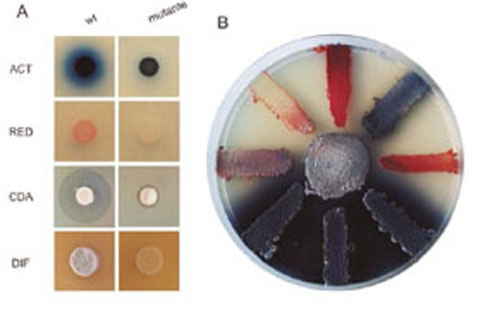
Figura 2. A. Efecto de la mutación de un regulador de respuesta sobre la producción de antibióticos de Streptomyces coelicolor y sobre su difereciación (DIF). Actinorrodina (ACT), undecilprodigiosina (RED), antibiótico dependiente de calcio (CDA). B. Efecto de distintas mutaciones en S. coelicolor sobre la producción de antibióticos, la cepa silvestre es la central.
Bibliografía representativa
Rico S., Yepes, A., Rodríguez, H., Santamaría, J., Antoraz, S., Krause, E., Díaz, M and Santamaría, RI. (2014 a). Regulation of the AbrA1/A2 two-component system in Streptomyces coelicolor and the potential of its deletion strain as a heterologous host for antibiotic production. (PLOS One en prensa)
Rico S, Santamaría RI, Yepes A, Rodríguez H, Laing E, Bucca G, Smith CP, Díaz M. (2014b). Deciphering the regulon of the Streptomyces coelicolor AbrC3, a positive response regulator of antibiotic production. Appl. Environ. Microbiology 80(8): 2417-2428.
Rodríguez, H., Rico, S., Díaz, M. and Santamaría, RI. (2013). Two-component systems in Streptomyces: key regulators of antibiotic complex pathways. Microbial Cell Factories 12:127.
Sevillano, L., Díaz, M. and Santamaría, RI. (2013). Stable expression plasmids for Streptomyces based on a toxin-antitoxin system. Microbial Cell Factories 12:39
Díaz, M., Sevillano, L., Rico, S., Lombo, F., Braña, AF., Salas, JA., Méndez, C. and Santamaría, RI. (2013). High level of antibiotic production in a double polyphosphate kinase and phosphate-binding protein mutant of Streptomyces lividans. FEMS letters 342, 123-129.
Sevillano L., Díaz, M. and Santamaría, RI. (2012). Identification of the first functional toxin-antitoxin system in Streptomyces. PloS One 7(3): e32977.
Yepes, A., Rico, S., Rodríguez, A., Santamaría, RI. and Díaz, M. (2011). Novel two-components systems involved in antibiotic regulation in Streptomyces coelicolor. PloS One 6(5): e19980.
Pérez, J, Muñoz-Dorado J, Braña AF, Shimkets L J, Sevillano L and Santamaría RI. (2011). Myxococcus xanthus induces actinorhodin overproduction and aerial mycelium formation by Streptomyces coelicolor. Microbial Biotechnology 4:175-183
Esteban A, Díaz M, Yepes A and Santamaría RI. (2008). Expression of the pstS gene of Streptomyces lividans is regulated by the carbon source and is partially independent of the PhoP regulator. BMC Microbiology 8:201 doi:10.1186/1471-2180-8-201
Díaz, M., Ferreras, E., Moreno, R., Yepes, A., Berenguer, J, and Santamaría, RI., (2008). High-level overproduction of Thermus enzymes in Streptomyces lividans. Applied Microbiology and Biotechnology 79, 1001-1008
